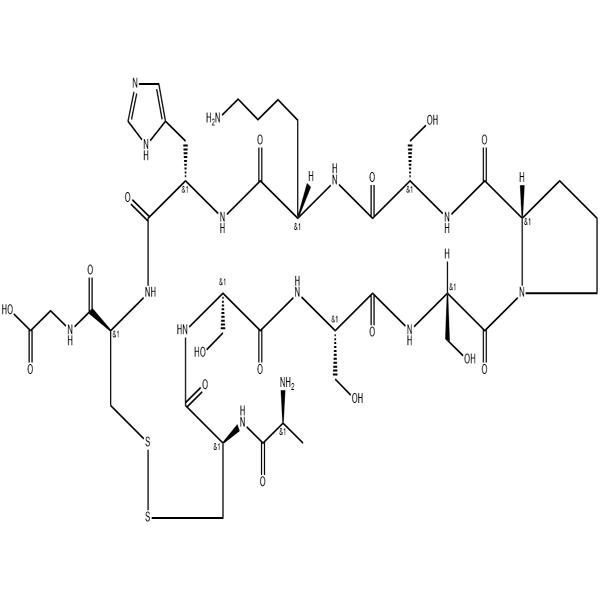
FITC-LC-TAT(47-57)/888486-23-5/GT Péptido/Proveedor de péptidos
Descripción
El disulfuro de péptido transdérmico (disulfuro (péptido) TD 1) es un polipéptido de 11 aminoácidos que se une a la subunidad beta de Na+/K+-ATPasa (ATP1B1).Interactúa principalmente con el extremo C de ATP1B1.El péptido disulfuro transdérmico puede mejorar la liberación de algunas macromoléculas en la piel.En presencia de disulfuro de péptido transdérmico, las células regulan positivamente los niveles de ATP1B1 para mantener la función y la estructura debido a la unión específica del disulfuro de péptido transdérmico a ATP1B1.
Especificaciones
Apariencia: Polvo blanco a blanquecino
Pureza (HPLC):≥98,0%
Impureza única:≤2,0%
Contenido de acetato (HPLC): 5,0%~12,0%
Contenido de agua (Karl Fischer):≤10,0%
Contenido de péptidos:≥80,0%
Embalaje y envío: Baja temperatura, envasado al vacío, precisión de mg según sea necesario.
¿Como ordenar?
1. Contact us directly by phone or email: +86-13735575465, sales1@gotopbio.com.
2. Ordene en línea.Por favor complete el formulario de pedido en línea.
3. Proporcione el nombre del péptido, número CAS o secuencia, pureza y modificación si es necesario, cantidad, etc. Le proporcionaremos una cotización dentro de 2 horas.
4. Conformación del pedido mediante contrato de venta debidamente firmado y NDA (acuerdo de confidencialidad) o acuerdo de confidencialidad.
5. Actualizaremos continuamente el progreso del pedido a tiempo.
6. La entrega de péptidos por DHL, Fedex u otros, y HPLC, MS, COA se proporcionarán junto con la carga.
7. Se seguirá la política de reembolso si hay alguna discrepancia con nuestra calidad o servicio.
8. Servicio postventa: Si nuestros clientes tienen alguna pregunta sobre nuestro péptido durante el experimento, no dude en contactarnos y le responderemos en poco tiempo.
Todos los productos de la empresa se utilizan únicamente con fines de investigación científica,'Está prohibido que cualquier persona lo utilice directamente en el cuerpo humano.
Preguntas más frecuentes:
¿Se redujeron los péptidos que contenían Cys antes del envío?
Si no se descubre que el péptido se ha oxidado, generalmente no reducimos Cys.Todos los polipéptidos se obtienen a partir de productos crudos purificados y liofilizados en condiciones de pH 2, que previenen al menos en cierta medida la oxidación de Cys.Los péptidos que contienen Cys se purifican a pH 2 a menos que exista una razón específica para purificarlos a pH 6,8.Si la purificación se realiza a pH 6,8, el producto purificado debe tratarse con ácido inmediatamente para evitar la oxidación.En el paso final de control de calidad, para los péptidos que contienen Cys, si se encuentra la presencia de una sustancia de peso molecular (2P+H) en el mapa de MS, indica que se ha formado un dímero.Si no hay ningún problema con MS y HPLC, liofilizaremos y enviaremos directamente los productos sin ningún procesamiento adicional.Cabe señalar que los péptidos que contienen Cys se oxidan lentamente con el tiempo y el grado de oxidación depende de la secuencia del péptido y las condiciones de almacenamiento.
¿Cómo se determina si un péptido tiene un bucle?
Usamos la reacción de Ellman para probar si la formación del anillo está completa.Si la prueba de Ellman es positiva (amarillo), la reacción del anillo está incompleta.Si los resultados de la prueba son negativos (no amarillos), la reacción del anillo se ha completado.No proporcionamos el informe de análisis de identificación de ciclación para nuestros clientes.Generalmente, habrá una descripción de los resultados de las pruebas de Ellman en el informe de control de calidad.
Necesito un péptido cíclico que contenga triptófano, ¿se oxidará?
La oxidación del triptófano es un fenómeno común en la oxidación de péptidos, y los péptidos generalmente se ciclan antes de la purificación.Si se produce la oxidación del triptófano, el tiempo de retención del péptido en la columna de HPLC cambiará y la oxidación podrá eliminarse mediante purificación.Además, la EM también puede detectar péptidos oxidados.
¿Es necesario dejar un espacio entre el péptido y el colorante?
Si va a unir una molécula grande (como un tinte) al péptido, es mejor dejar un espacio entre el péptido y el ligando para minimizar la interferencia con el receptor por el plegamiento del propio péptido o por el plegamiento de su conjugado.Otros no quieren intervalos.Por ejemplo, en el plegamiento de proteínas, es posible determinar qué tan separada está la estructura de plegamiento de un aminoácido uniendo un tinte fluorescente a un sitio particular.
Si desea realizar una modificación de biotina en el terminal N, ¿es necesario dejar un espacio entre la biotina y la secuencia peptídica?
El procedimiento estándar de etiquetado de biotina utilizado por nuestra empresa es unir un Ahx a la cadena peptídica, seguido de biotina.Ahx es un compuesto de 6 carbonos que actúa como barrera entre el péptido y la biotina.
¿Puede darnos algún consejo sobre el diseño de péptidos fosforilados?
A medida que aumenta la longitud, la eficacia de unión disminuye gradualmente a partir del aminoácido fosforilado.La dirección de síntesis es desde el terminal C al terminal N.Se recomienda que los residuos después del aminoácido fosforilado no excedan 10, es decir, el número de residuos de aminoácidos antes del aminoácido fosforilado desde el terminal N al terminal C no debe exceder 10.
¿Por qué la acetilación n-terminal y la amidación C-terminal?
Estas modificaciones evitan que el péptido se degrade y permiten que imite su estado original de grupos alfa amino y carboxilo en la proteína original.