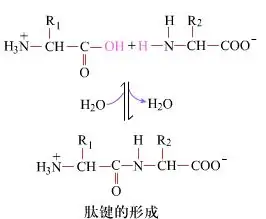
En la superficie, la formación de enlaces peptídicos, produciendo dipéptidos, es un proceso químico simple. Esto significa que los dos componentes de aminoácidos están unidos por un enlace péptido, un enlace de amida, mientras se deshidratan.
La formación de enlaces de péptidos es la activación de un aminoácido en condiciones de reacción suaves. (A) Recho carboxilo, segundo aminoácido (B) El resto carboxilo activado nucleófilo luego forma el dipéptido (A-B). "Si el componente carboxilo (a) no está protegido, la formación del enlace péptido no se puede controlar". Los subproductos como los péptidos lineales y cíclicos pueden mezclarse con los compuestos objetivo A-B. Por lo tanto, todos los grupos funcionales que no están involucrados en la formación de enlaces de péptidos deben protegerse de una manera temporalmente reversible durante la síntesis de péptidos.
Entonces, la síntesis de péptidos, la formación de cada enlace péptido, implica tres pasos de agregación.
El primer paso es preparar algunos aminoácidos que necesitan protección, y la estructura zwitteriónica de los aminoácidos ya no existe.
El segundo paso es una reacción de dos pasos para formar enlaces peptídicos, en el que el grupo carboxilo del aminoácido protegido N se activa primero al intermedio activo y luego se forma el enlace péptido. Esta reacción acoplada puede ocurrir como una reacción de un solo paso o como dos reacciones secuenciales.
El tercer paso es la eliminación selectiva o la eliminación completa de la base protectora. Aunque toda la eliminación solo puede ocurrir después de que todas las cadenas de péptidos se hayan ensamblado, también se requiere eliminación selectiva de grupos protectores para continuar la síntesis de péptidos.
Porque 10 aminoácidos (Ser, Thr, Tyr, ASP, Glu, Lys, Arg, His, Sec y Cys) contienen grupos funcionales de la cadena lateral, que requieren protección selectiva, lo que hace que la síntesis de péptidos sea más complicada. Las bases de protección temporales y semipermanentes deben distinguirse debido a los diferentes requisitos de selectividad. Los grupos de protección temporal se utilizan en el siguiente paso para reflejar la protección temporal de los grupos funcionales de aminoácidos o carboxilo. Los grupos protectores semipermanentes se eliminan sin interferir con enlaces peptídicos ya formados o cadenas laterales de aminoácidos, a veces durante la síntesis.
"Idealmente, la activación del componente carboxilo y la posterior formación de enlaces peptídicos (reacciones de acoplamiento) deben ser rápida, sin formación de racémico o subproducto, y los reactivos molares deben aplicarse para lograr altos rendimientos". Desafortunadamente, ninguno de los métodos de acoplamiento químico satisface estos requisitos, y pocos son adecuados para la síntesis práctica.
Durante la síntesis de péptidos, los grupos funcionales involucrados en diversas reacciones generalmente están vinculados al centro manual, siendo la glicina la única excepción, y existe un riesgo potencial de rotación.
El paso final en el ciclo de síntesis de péptidos es la eliminación de todos los grupos protectores. La eliminación selectiva de grupos protectores es importante para la extensión de la cadena de péptidos además del requisito de eliminación completa de la protección en la síntesis de dipéptidos. Las estrategias sintéticas deben planificarse cuidadosamente. Dependiendo de la elección estratégica, N puede eliminar selectivamente los grupos de protección α-amino o carboxilo. El término "estrategia" se refiere a la secuencia de reacciones de condensación de aminoácidos individuales. En general, hay una diferencia entre la síntesis gradual y la condensación del fragmento. La síntesis de péptidos (también conocida como "síntesis convencional") tiene lugar en solución. En la mayoría de los casos, el alargamiento gradual de la cadena de péptidos solo se puede sintetizar usando la cadena de péptidos para sintetizar fragmentos más cortos. Para sintetizar péptidos más largos, las moléculas objetivo deben segmentarse en fragmentos apropiados y determinar que pueden minimizar el grado de diferenciación en el terminal C. Después de que los fragmentos individuales se ensamblen gradualmente, el compuesto objetivo se unirá. La estrategia de síntesis de péptidos incluye la selección del mejor y más apropiado fragmento de protección, y la estrategia de síntesis de péptidos incluye la selección de la combinación más apropiada de bases de protección y el mejor método de conjugación de fragmentos.
Tiempo de publicación: 2025-07-02