Los péptidos son una clase de compuestos formados por la conexión de múltiples aminoácidos a través de enlaces péptidos. Son ubicuos en los organismos vivos. Hasta ahora, se han encontrado decenas de miles de péptidos en organismos vivos. Los péptidos juegan un papel importante en la regulación de las actividades funcionales de varios sistemas, órganos, tejidos y células y en actividades de vida, y a menudo se usan en análisis funcional, investigación de anticuerpos, desarrollo de fármacos y otros campos. Con el desarrollo de la biotecnología y la tecnología de síntesis de péptidos, se han desarrollado y aplicado cada vez más medicamentos peptídicos en la clínica.
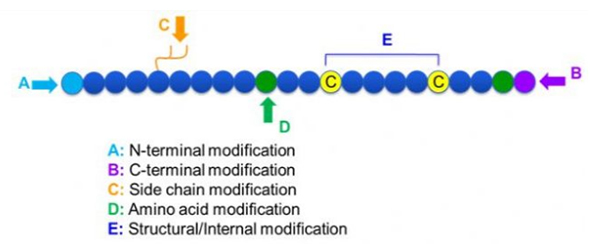
Existen una amplia variedad de modificaciones de péptidos, que se pueden dividir simplemente en la modificación posterior y la modificación del proceso (utilizando la modificación de aminoácidos derivados) y la modificación N-terminal, la modificación C-terminal, la modificación de la cadena lateral, la modificación de aminoácidos, la modificación del esqueleto, etc., dependiendo del sitio de modificación (Figura 1). Como un medio importante para cambiar la estructura de la cadena principal o los grupos de cadena de la cadena lateral de las cadenas de péptidos, la modificación de los péptidos puede cambiar efectivamente las propiedades físicas y químicas de los compuestos de péptidos, aumentar la solubilidad del agua, prolongar el tiempo de acción in vivo, cambiar sus distribución biológica, eliminar la inmunogenicidad, reducir los efectos secundarios tóxicos, etc., etc.
1. Ciclación
Los péptidos cíclicos tienen muchas aplicaciones en biomedicina, y muchos péptidos naturales con actividad biológica son péptidos cíclicos. Debido a que los péptidos cíclicos tienden a ser más rígidos que los péptidos lineales, son extremadamente resistentes al sistema digestivo, pueden sobrevivir en el tracto digestivo y exhibir una afinidad más fuerte por los receptores objetivo. La ciclación es la forma más directa de sintetizar péptidos cíclicos, especialmente para péptidos con un gran esqueleto estructural. De acuerdo con el modo de ciclación, se puede dividir en el tipo de cadena de cadena lateral, tipo de cadena lateral terminal, tipo terminal terminal (tipo de extremo a extremo).
(1) Sidechain a Sidechain
El tipo más común de ciclación de cadena lateral a la cadena lateral es el puente disulfuro entre los residuos de cisteína. Esta ciclación es introducida por un par de residuos de cisteína desprotegidos y luego oxidado para formar enlaces disulfuro. La síntesis policíclica se puede lograr mediante la eliminación selectiva de grupos de protección de sulfhidrilo. La ciclación se puede hacer en un disolvente posterior a la disociación o en una resina previa a la disociación. La ciclación en las resinas puede ser menos efectiva que la ciclación del solvente porque los péptidos en las resinas no forman fácilmente conformaciones ciclificadas. Otro tipo de ciclación de la cadena lateral de cadena lateral es la formación de una estructura de amida entre un residuo de ácido asparto o ácido glutámico y el aminoácido base, lo que requiere que el grupo de protección de la cadena lateral debe ser eliminado selectivamente del polipéptido en la resina o después de la disociación. El tercer tipo de ciclación de cadena lateral de cadena lateral es la formación de éteres de difenil por tirosina o p-hidroxifenilglicina. Este tipo de ciclación en productos naturales solo se encuentra en productos microbianos, y los productos de ciclación a menudo tienen un valor medicinal potencial. La preparación de estos compuestos requiere condiciones de reacción únicas, por lo que a menudo no se usan en la síntesis de péptidos convencionales.

(2) Terminal a sidechain
La ciclación de la cadena del lado terminal generalmente implica el terminal C con el grupo amino de la cadena lateral de lisina o ornitina, o el N-terminal con el ácido aspártico o la cadena lateral del ácido glutámico. Otra ciclación de polipéptidos se realiza formando enlaces de éter entre C y cadenas laterales de serina o treonina.
(3) Terminal o de cabeza a cola
Los polipéptidos de la cadena se pueden ciclar en un disolvente o fijarse en una resina por ciclación de cadena lateral. Se deben usar bajas concentraciones de péptidos en la centralización del disolvente para evitar la oligomerización de péptidos. El rendimiento de un polipéptido de anillo sintético de cabeza a cola depende de la secuencia del polipéptido de cadena. Por lo tanto, antes de preparar péptidos cíclicos a gran escala, primero se debe crear una biblioteca de posibles péptidos de plomo encadenados, seguido de la ciclación para encontrar la secuencia con los mejores resultados.
2. N-metilación
La N-metilación ocurre originalmente en los péptidos naturales y se introduce en síntesis de péptidos para evitar la formación de enlaces de hidrógeno, lo que hace que los péptidos sean más resistentes a la biodegradación y la aclaración. La síntesis de péptidos utilizando derivados de aminoácidos N-metilado es el método más importante. Además, también se puede utilizar la reacción de Mitsunobu de intermedios de resina polipéptidos con metanol de 2-nitrobenceno sulfonilo). Este método se ha utilizado para preparar bibliotecas de péptidos cíclicos que contienen aminoácidos N-metilados.
3. Fosforilación
La fosforilación es una de las modificaciones postraduccionales más comunes en la naturaleza. En las células humanas, más del 30% de las proteínas están fosforiladas. La fosforilación, especialmente la fosforilación reversible, juega un papel importante en el control de muchos procesos celulares, como la transducción de señales, la expresión génica, el ciclo celular y la regulación del citoesqueleto, y la apoptosis.
La fosforilación se puede observar en una variedad de residuos de aminoácidos, pero los objetivos de fosforilación más comunes son los residuos de serina, treonina y tirosina. Los derivados de fosfotirosina, fosfotreonina y fosfoserina pueden introducirse en péptidos durante la síntesis o formarse después de la síntesis de péptidos. La fosforilación selectiva se puede lograr utilizando residuos de serina, treonina y tirosina que eliminan selectivamente grupos de protección. Algunos reactivos de fosforilación también pueden introducir grupos de ácido fosfórico en el polipéptido mediante la modificación posterior. En los últimos años, la fosforilación de lisina específica del sitio se ha logrado utilizando una reacción químicamente selectiva de fosfito staudinger-fosfito (Figura 3).

4. Myristoilación y palmitoilación
La acilación del N-terminal con ácidos grasos permite que los péptidos o proteínas se unan a las membranas celulares. La secuencia miridamoilada en el terminal N-terminal permite que las proteínas quinasas de la familia SRC y las proteínas de transcriptasa reinsegra de la transcriptasa sean dirigidas a unirse a las membranas celulares. El ácido mirístico se vinculó con el terminal N del polipéptido de resina utilizando reacciones de acoplamiento estándar, y el lipopéptido resultante podría disociarse en condiciones estándar y purificado por RP-HPLC.
5. Glicosilación
Los glucopéptidos como la vancomicina y la teicolanina son antibióticos importantes para el tratamiento de infecciones bacterianas resistentes a los fármacos, y otros glucopéptidos a menudo se usan para estimular el sistema inmune. Además, dado que muchos antígenos microbianos están glucosilados, es de gran importancia estudiar glucopéptidos para mejorar el efecto terapéutico de la infección. Por otro lado, se ha encontrado que las proteínas en la membrana celular de las células tumorales exhiben glucosilación anormal, lo que hace que los glucopéptidos jueguen un papel importante en el cáncer y la investigación de defensa inmune tumoral. Los glucopéptidos se preparan mediante el método FMOC/T-BU. Los residuos glucosilados, como la treonina y la serina, a menudo se introducen en polipéptidos por el éster de pentafluorófenol FMOC activados para proteger los aminoácidos glucosilados.
6. isopreno
La isopentadienilación ocurre en los residuos de cisteína en la cadena lateral cerca del terminal C. El isopreno de proteína puede mejorar la afinidad de la membrana celular y formar interacción proteína-proteína. Las proteínas isOpentadienated incluyen tirosina fosfatasa, GTasa pequeña, moléculas de cochaperona, lámina nuclear y proteínas de unión centroméricas. Los polipéptidos de isopreno se pueden preparar usando isopreno en resinas o introduciendo derivados de cisteína.
7. Modificación de polietilenglicol (PEG)
La modificación de PEG se puede utilizar para mejorar la estabilidad hidrolítica de proteínas, la biodistribución y la solubilidad de los péptidos. La introducción de las cadenas de PEG a los péptidos puede mejorar sus propiedades farmacológicas y también inhibir la hidrólisis de los péptidos por enzimas proteolíticas. Los péptidos PEG pasan a través de la sección transversal capilar glomerular más fácilmente que los péptidos ordinarios, reduciendo en gran medida el espacio libre renal. Debido a la vida media activa extendida de los péptidos PEG in vivo, el nivel de tratamiento normal se puede mantener con dosis más bajas y fármacos peptídicos menos frecuentes. Sin embargo, la modificación de PEG también tiene efectos negativos. Grandes cantidades de PEG evitan que la enzima degrade el péptido y también reduzca la unión del péptido al receptor objetivo. Pero la baja afinidad de los péptidos PEG generalmente se compensa con su vida media farmacocinética más larga, y al estar presentes en el cuerpo más largo, los péptidos PEG tienen una mayor probabilidad de ser absorbidos en los tejidos objetivo. Por lo tanto, las especificaciones del polímero PEG deben optimizarse para obtener resultados óptimos. Por otro lado, los péptidos PEG se acumulan en el hígado debido a la eliminación renal reducida, lo que resulta en síndrome macromolecular. Por lo tanto, las modificaciones de PEG deben diseñarse con más cuidado cuando los péptidos se usan para las pruebas de drogas.

Common modification groups of PEG modifiers can be roughly summarized as follows: Amino (-amine) -NH2, aminomethyl-Ch2-NH2, hydroxy-OH, carboxy-Cooh, sulfhydryl (-Thiol) -SH, Maleimide -MAL, succinimide carbonate -SC, succinimide acetate -SCM, succinimide propionate -SPA, n-hidroxisuccinimida -nHS, acrilato-ch2ch2Cooh, aldehído -cho (como propional-al-al, butyrald), base acrílica (-acrylate-acrl), azido-azideo, biotinil-biotina, fluoresceín p -toluenesulfonato -ots, succinimida succinato -ss, etc. Los derivados de PEG con ácidos carboxílicos pueden acoplarse a aminas N -terminales o cadenas laterales de lisina. La PEG aminoactivada puede acoplarse a cadenas laterales de ácido asparto o ácido glutámico. El PEG mal activado se puede conjugarse con mercaptán de cadenas laterales de cisteína totalmente desprotectadas [11]. Los modificadores de PEG se clasifican comúnmente de la siguiente manera (Nota: MPEG es Metoxi-PEG, CH3O- (CH2CH2O) N-CH2CH2-OH):
(1) Modificador de clavijas de cadena recta
MPEG-SC, MPEG-SCM, MPEG-SPA, MPEG-STS, MPEG-SH, MPEG-ALD, MPEG-BUTYRALD, MPEG-SS
(2) Modificador de PEG bifuncional
HCOO-PEG-COOH, NH2-PEG-NH2, OH-PEG-COOH, OH-PEG-NH2, HCL · NH2-PEG-COOH, MAL-PEG-NHS
(3) Modificador de clavijas de ramificación
(MPEG) 2-NHS, (MPEG) 2-ALD, (MPEG) 2-NH2, (MPEG) 2-MAL
8. Biotinización
La biotina puede estar fuertemente unida con avidina o estreptavidina, y la fuerza de unión está incluso cerca del enlace covalente. Los péptidos marcados con biotina se usan comúnmente en citometría de flujo basada en inmunoensayo, histocitoquímica y fluorescencia. Los anticuerpos antibiotinos marcados también se pueden usar para unir péptidos biotinilados. Las etiquetas de biotina a menudo se unen a la cadena lateral de lisina o al terminal N. El ácido 6-aminocaproico a menudo se usa como un enlace entre los péptidos y la biotina. El enlace es flexible en la unión al sustrato y se une mejor en presencia de un obstáculo estérico.
9. Etiquetado fluorescente
El marcado fluorescente se puede usar para rastrear polipéptidos en las células vivas y para estudiar enzimas y mecanismos de acción. El triptófano (TRP) es fluorescente, por lo que puede usarse para el etiquetado intrínseco. El espectro de emisión del triptófano depende del entorno periférico y disminuye con la disminución de la polaridad del solvente, una propiedad que es útil para detectar la estructura de los péptidos y la unión del receptor. La fluorescencia de triptófano puede apagarse por ácido aspártico protonado y ácido glutámico, lo que puede limitar su uso. El grupo de cloruro de dansyl (dansyl) es altamente fluorescente cuando se une a un grupo amino y a menudo se usa como etiqueta fluorescente para aminoácidos o proteínas.
La conversión de energía de resonancia de fluorescencia (FRET) es útil para los estudios enzimáticos. Cuando se aplica FRET, el polipéptido de sustrato generalmente contiene un grupo de marcado de fluorescencia y un grupo de fluorescencia. Los grupos fluorescentes marcados son apagados por el apagón a través de la transferencia de energía no fotón. Cuando el péptido se disocia de la enzima en cuestión, el grupo de marcado emite fluorescencia.
10. Polipéptidos de la jaula
Los péptidos de la jaula tienen grupos protectores ópticamente extraíbles que protegen el péptido de la unión al receptor. Cuando se expone a la radiación UV, se activa el péptido, restaurando su afinidad al receptor. Debido a que esta activación óptica se puede controlar de acuerdo con el tiempo, la amplitud o la ubicación, los péptidos de la jaula pueden usarse para estudiar las reacciones que ocurren en las células. Los grupos protectores más utilizados para los polipéptidos de la jaula son los grupos 2-nitrobencilo y sus derivados, que pueden introducirse en la síntesis de péptidos a través de derivados de aminoácidos protectores. Los derivados de aminoácidos que se han desarrollado son lisina, cisteína, serina y tirosina. Sin embargo, los derivados de aspartato y glutamato no se usan comúnmente debido a su susceptibilidad a la ciclación durante la síntesis y disociación de péptidos.
11. Péptido poliantigénico (mapa)
Los péptidos cortos generalmente no son inmunes y deben acoplarse a proteínas portadoras para producir anticuerpos. El péptido poliantigénico (MAP) está compuesto por múltiples péptidos idénticos conectados a los núcleos de lisina, que pueden expresar específicamente los inmunógenos de alta potencia y pueden usarse para preparar pareadas de proteínas péptidos-portadores. Los polipéptidos MAP se pueden sintetizar mediante síntesis de fase sólida en la resina MAP. Sin embargo, el acoplamiento incompleto da como resultado cadenas peptídicas faltantes o truncadas en algunas ramas y, por lo tanto, no exhibe las propiedades del polipéptido mapa original. Como alternativa, los péptidos se pueden preparar y purificar por separado y luego acoplarse para mapear. La secuencia de péptidos unida al núcleo del péptido está bien definida y se caracteriza fácilmente por la espectrometría de masas.
Conclusión
La modificación de los péptidos es un medio importante para diseñar péptidos. Los péptidos modificados químicamente no solo pueden mantener una alta actividad biológica, sino también evitar efectivamente los inconvenientes de la inmunogenicidad y la toxicidad. Al mismo tiempo, la modificación química puede dotar a los péptidos con algunas nuevas propiedades excelentes. En los últimos años, el método de activación de C-H para la posmodificación de polipéptidos se ha desarrollado rápidamente, y se han logrado muchos resultados importantes.
Tiempo de publicación: 2025-07-03
