Según la forma de conexión del aminoácido y el azúcar, el péptido de azúcar se puede dividir en cuatro categorías: glicosilación de O, glicosilación de C a N, sacarificación de rocío y conexión GPI (glucofosfatidilinositol).
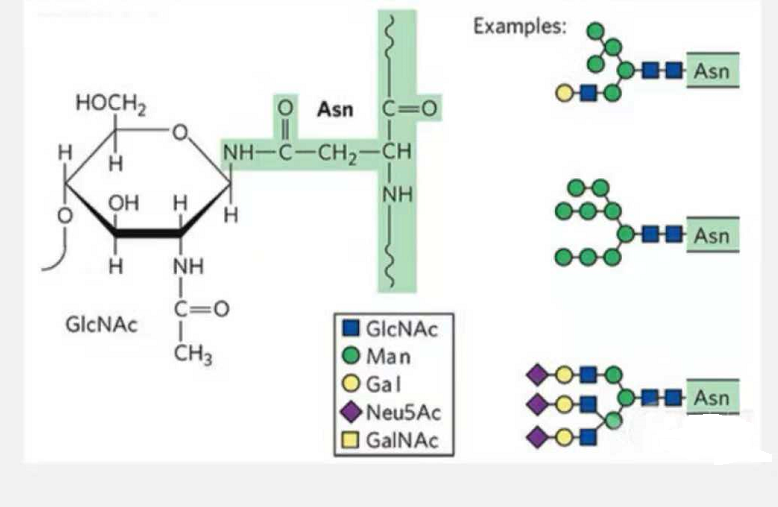
1. Los glicopéptidos de N-glicosilación están compuestos de N-acetamida-glucosa en el extremo reductor de la cadena de glicano (Glc-Nac) unida al átomo de N en el grupo amida de la cadena lateral de algunos Asn en la cadena peptídica, y el Asn capaz de enlazar la cadena de glicano debe ubicarse en el AsN-X-Ser /Thr (X! =P) en el motivo formado por los residuos.El azúcar es N-acetilglucosamina.
Glicopéptido estructural modificado por N-glicosilación
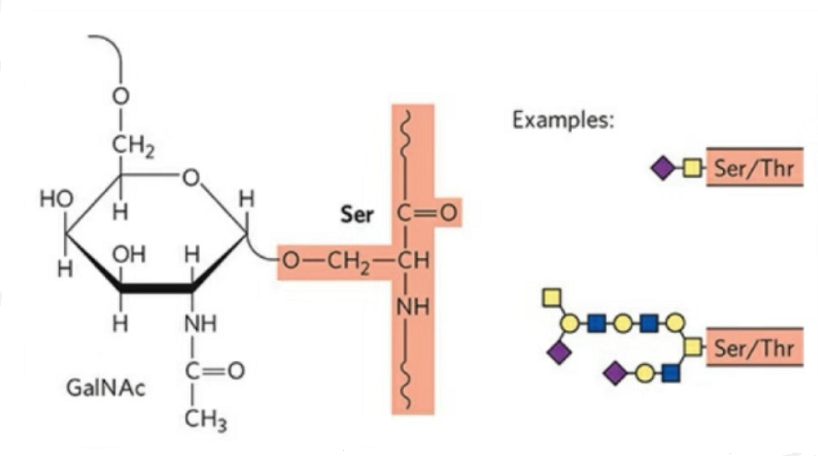
2. La estructura de la O-glicosilación es más simple que la N-glicosilación.Este glicopéptido es generalmente más corto que el glicano, pero tiene más tipos que la N-glicosilación.Ser y Thr generalmente pueden glicosilarse en la cadena peptídica.Además, existen glicopéptidos decorados con glicosilación de tirosina, hidroxilo e hidroxiprolina.La posición del enlace es el átomo de oxígeno del hidroxilo en la cadena lateral del residuo.Los azúcares unidos son galactosa o N-acetilgalactosamina (Gal&GalNAc) o glucosa/glucosamina (Glc/GlcNAc), manosa/manosamina (Man/ManNAc), etc.
La O-glicosilación modifica la estructura.
3. Glicosilación del glicopéptido O-GlcNAC ((N-acetilcisteína (NAC)) (glcnAcN-acetilglucosamina/acetilglucosamina)
Una única glicosilación de N-acetilglucosamina (GlcNAc) conecta las proteínas O-GlcNAc con el átomo de oxígeno hidroxilo del residuo de serina o treonina de una proteína.La glicosilación de O-GlcNA es un adorno de monosacárido de O-GlcNAc sin extensión de glucano;Al igual que la fosforilación de péptidos, la glicosilación de glicopéptidos con O-GlcNAc también es un proceso dinámico de decoración de proteínas.La decoración anormal de O-GlcNAc puede causar una variedad de enfermedades como diabetes, enfermedades cardiovasculares, tumores, enfermedad de Alzheimer, etc.
Puntos de glicosilación de glicopéptidos.
Las estructuras básicas de las cadenas polipeptídicas y de azúcar están unidas a las cadenas de proteínas mediante enlaces covalentes, y los sitios que unen las cadenas de azúcar se denominan sitios de glicosilación.Dado que no existe una plantilla para seguir la biosíntesis de las cadenas de azúcar de glicopéptidos, se unirán diferentes cadenas de azúcar al mismo sitio de glicosilación, lo que dará lugar a la denominada falta de homogeneidad microscópica.
Glicosilación de glicopéptidos
1. Efecto de la glicosilación de glicopéptidos sobre la eficacia terapéutica de las proteínas terapéuticas
En el caso de las proteínas terapéuticas, la glicosilación también afecta la vida media y la dirección de los fármacos proteicos in vivo.
2. Glicosilación de glicopéptidos solubles y proteínas.
Los estudios han demostrado que las cadenas de azúcar en la superficie de las proteínas pueden mejorar la solubilidad molecular de las proteínas.
3. Glicosilación de glicopéptidos e inmunogenicidad de proteínas.
Por un lado, las cadenas de azúcar en la superficie de las proteínas pueden inducir respuestas inmunitarias específicas.Por otro lado, las cadenas de azúcar pueden cubrir ciertas superficies de la superficie de la proteína y reducir su inmunogenicidad.
4. Glicosilación de glicopéptidos que aumenta la estabilidad de las proteínas.
La glicosilación puede aumentar la estabilidad de las proteínas ante diversas condiciones de desnaturalización (como desnaturalizantes, calor, etc.) y evitar la agregación de proteínas.Al mismo tiempo, las cadenas de azúcar en la superficie de las proteínas también pueden cubrir algunos puntos de degradación proteolítica de las moléculas de proteínas, aumentando así la resistencia de las proteínas a las proteinasas.
5. Glicosilación de glicopéptidos que afecta la actividad biológica de las moléculas de proteínas.
Cambiar la glicosilación de proteínas también puede permitir que las moléculas de proteínas formen nuevas actividades biológicas
Hora de publicación: 03-ago-2023